Ⅰ. 서론
Ⅱ. 재료 및 방법
1. 핸드피스와 식립체에 잔류하는 윤활제 양에 대한 평가
2. 핸드피스 윤활제가 생체에 미치는 영향력에 대해 알아보고자 L929 세포를 이용한 세포독성평가
3. 핸드피스 윤활제가 생체에 미치는 영향력에 대해 추가로 알아보고자 소동물(백서)을 이용하여 염증 발현 여부에 대한 검증
Ⅲ. 결과
1. 핸드피스 내의 윤활제 잔류량
2. 핸드피스 오일링 이후 식립 직전까지의 단계별 핸드피스에 잔류하는 윤활제 양에 대한 검증
3. 식립체에 잔류하는 윤활제 양에 대한 검증
4. L929 세포를 이용한 세포독성평가
5. 핸드피스 윤활제가 생체에 미치는 영향력에 대해 추가로 알아보고자 소동물(백서)을 이용하여 염증 발현 여부에 대한 검증
Ⅳ. 고찰 및 결론
Ⅰ. 서론
치과 영역에서 임플란트 수복은 부분 또는 완전 무치악 환자에게서 널리 사용되는 치료 방법이다. 1951년 이후 Brånemark이 티타늄의 우수한 생체친화성에 관한 연구결과를 바탕으로 임플란트를 개발 하여 1965년 처음 환자에게 시술하였으며, 1969년 임상결과를 발표하면서 골융합(osseointegration)의개념을 소개하였다.
골융합은 광학현미경 하에서 살아 있는 골과, 하중을 전달하는 골내 고정체 계면간의 직접적인 구조 적, 기능적 결합을 말하는데,1, 2 이러한 골융합을 위한 중요한 요소인 생체적합성은 표면처리나 젖음성, 화학적 구성과 같은 성질에 따라서 달라질 수 있다. 3, 4, 5 그 중에서 임플란트의 디자인과 표면형태는 세포적 활동성과 골조직과의 접촉률에 영향을 주어 결과적으로 골조직의 치유와 골개조에 많은 영향을 미친다.6, 7, 8 그렇기 때문에 임플란트 식립체의 표면은 반드시 멸균된 상태로 어떤 다른 금속이나 단백질 성분과 접촉되지 않아야 하고, 생활골에 정밀한 적합이 이루어져야 하는 것으로 알려져 있다.9, 10, 11, 12, 13
지난 수십 년간 임플란트 관련한 술식과 임플란트 식립체(fixture)의 표면처리 방식에 많은 진전이 있었고, 그로 인해 임플란트의 성공률이 과거에 비해 비약적으로 높아졌다. 하지만 여전히 임플란트를 이용한 치료에서 여러 문제점들이 발견되어 실패하고 있음에도, 그 원인은 명확하게 밝혀지지 않았다. 특히 임플란트의 조기 실패에 있어서는 수술 중 악골의 외상, 급성 감염, 초기 고정의 부족, 임플란트 식립 체의 생체적합성의 부족, 환자의 전신건강 등 여러 가지 요소가 원인으로 제시되고 있으며14 식립 과정중 임플란트 식립체가 오염되었을 경우에서도 발생할 수 있다고 한다. 그 중에서도 식립을 위해 사용하는 치과용 핸드피스의 윤활제에 의해서 식립체가 오염될 수 있으며 그로 인해 임플란트가 실패할 수도 있다는 가능성이 제기되었다.
치과용 핸드피스는 항상 교차감염의 위험이 있지만 복잡한 구조 때문에 세척하고 소독하는 것이 쉽지는 않다. 그래서 제조사의 지시에 따라 핸드피스로 인한 감염방지와 상태유지를 위해서 일반적으로 스프레이 형태의 윤활제를 사용하여 핸드피스 내 분사를 하고 난 후 수 분간의 공회전을 통해서 과도한 양의 윤활제를 제거하는 과정을 거치게 된다. 일부 문헌에 의하면 이러한 과정을 정확하게 하지 않았을 때, 일부 윤활제가 남아 임플란트 식립체의 표면을 오염시키고 임플란트의 젖음성을 변화시키고, 세포의 응집, 분화, 성숙을 방해할 수도 있다고 한다.14, 15
그럼에도 핸드피스 세척을 위한 윤활제가 임플란트 식립체에 미치는 영향에 대한 연구는 아직 많지 않아 윤활제의 잔류가 생체 내 미치는 영향에 대해 파악하고, 나아가서 임플란트의 예후와도 연관성이 있는지에 대해 알아보고자 본 연구를 기획하게 되었다.
Ⅱ. 재료 및 방법
1. 핸드피스와 식립체에 잔류하는 윤활제 양에 대한 평가
(1) 실험 재료
실험에 사용된 임플란트 식립체는 길이 8 mm, 직경 3.5 mm의 TS III 임플란트(Osstem implant Co., Ltd., Korea)이며, 핸드피스의 오일링에 사용된 오일은 KaVo Spray(KaVo Dental GmbH., Germany)이다.
(2) 연구 방법
1) 핸드피스 내 윤활제 잔류량 및 오일링 이후 식립 직전까지 단계별 식립체의 윤활제 잔류량에 대한 검증
우선 윤활제의 휘발 여부를 검증하기 위해 3개의 유리 vial에 윤활제를 2초동안 분사 후 160℃에서의 무게 변화를 관찰하였다. 다음으로 제조사가 권장한 세척 단계에 따라 그룹을 나누었고 각 그룹별로 3 개의 핸드피스를 이용하여 실험하였다. 실험 방법은 핸드피스 무게를 측정하여 잔류하고 있는 윤활제의 양을 추정하였으며, A그룹은 윤활제를 2회에 걸쳐 2초간 적용을 하는 오일링 단계만, B그룹은 오일 링과 1,500 rpm으로 30초 공회전을 하여 잔여 오일을 제거하는 단계를, C군은 오일링과 15시간 동안 핸드피스를 세워서 잔여 윤활제를 제거하는 자연배출단계를, D군은 오일링과 공회전, 자연배출 모두 시행하였다. 이 과정에서, 핸드피스의 관리 절차에만 차이를 두기 위해서 무치악 모형에 임플란트 식립할때 드릴링은 1,500 rpm으로 20초간, 식립은 12 rpm으로 3초간 시행하여 그룹간의 차이가 없도록 하였다.
2) 식립체에 잔류하는 윤활제 양에 대한 검증
실험은 No-mount TS III SA fixture를 이용하였다. Control 그룹에서는 어떠한 처리도 하지 않았으 며, WC(worst case) 그룹에서는 윤활제에 식립체를 침지하였다. 식립체에 윤활제를 용출한 후 GC 정량 분석을 통해 잔류량을 추정하는 방법으로 실험하였다.
2. 핸드피스 윤활제가 생체에 미치는 영향력에 대해 알아보고자 L929 세포를 이용한 세포독성평가
(1) 실험 재료
실험에 사용된 재료는 L929 세포(ATCC CCL1. MCTC Clone 929)와 인산완충용액(PBS, Gibco ® , Grand Island, NY, USA), dimethyl sulfoxide(DMSO, SIGMA-ALDRICH, USA)용액과 MTS assay kit(CellTiter 96 ® AQueous One Solution Cell Proliferation Assay, Promega, USA)가 사용되었다.
(2) 연구 방법
96well microplate에 well 당 1 × 10 4 ~ 1 × 10 6 의 세포수가 되도록 L-929 세포를 분주한 후, 측정하 고자 하는 핸드피스 오일을 농도별로 각 well에 첨가하였다. 그리고 시험물질이 충분히 노출될 수 있도록 37℃, 5%, CO 2 incubator에 24시간 배양 후 MTS assay를 하였다. 세포 생존율을 비교하기 위해 MTS/PMs solution을 이용하였고 485 nm 파장에서의 흡광도를 측정하였다.
3. 핸드피스 윤활제가 생체에 미치는 영향력에 대해 추가로 알아보고자 소동물(백서)을 이용하여 염증 발현 여부에 대한 검증
(1) 실험 재료
몸무게 220-250 g의 8주령의 Sprague-Dawley계 흰쥐 33마리를 대상으로 실험을 진행하였다. 실험 동물의 사육은 실내온도 25±1℃가 유지되는 사육실에서 각각 분리되어 사육하였고, 표준화된 먹이와 멸균된 음수를 제공하였다. 이 실험은 오스템임플란트 동물실험 윤리위원회의 심의를 거친 후 진행하 였다(OST-IACUC-18-03). 실험에 사용된 임플란트 식립체는 길이 8 mm, 직경 3.5 mm의 TS III 임플 란트(Osstem implant Co., Ltd., Korea)이며, 핸드피스의 오일링에 사용된 오일은 KaVo Spray(KaVo Dental GmbH., Germany)이다.
(2) 연구 방법
1) 마취
아이소플루레인(Isotroy100, Troikaa Phama ceuticals Ltd., Gujarat, India) 3%를 호흡마취기를 통하여 전신마취를 유도한 후, 졸레틸 (Zolazepam/tiletamin, Vibac Korea Ltd., Seoul, Korea) 30 ml/Kg와 2% 럼푼 (Xylazine HCl, Bayer Korea Ltd., Seoul, Korea) 10 mg/Kg을 대퇴부에 근육주사하여 마취를 진행하였다.
2) 수술 방법
① 자극성에 대한 평가
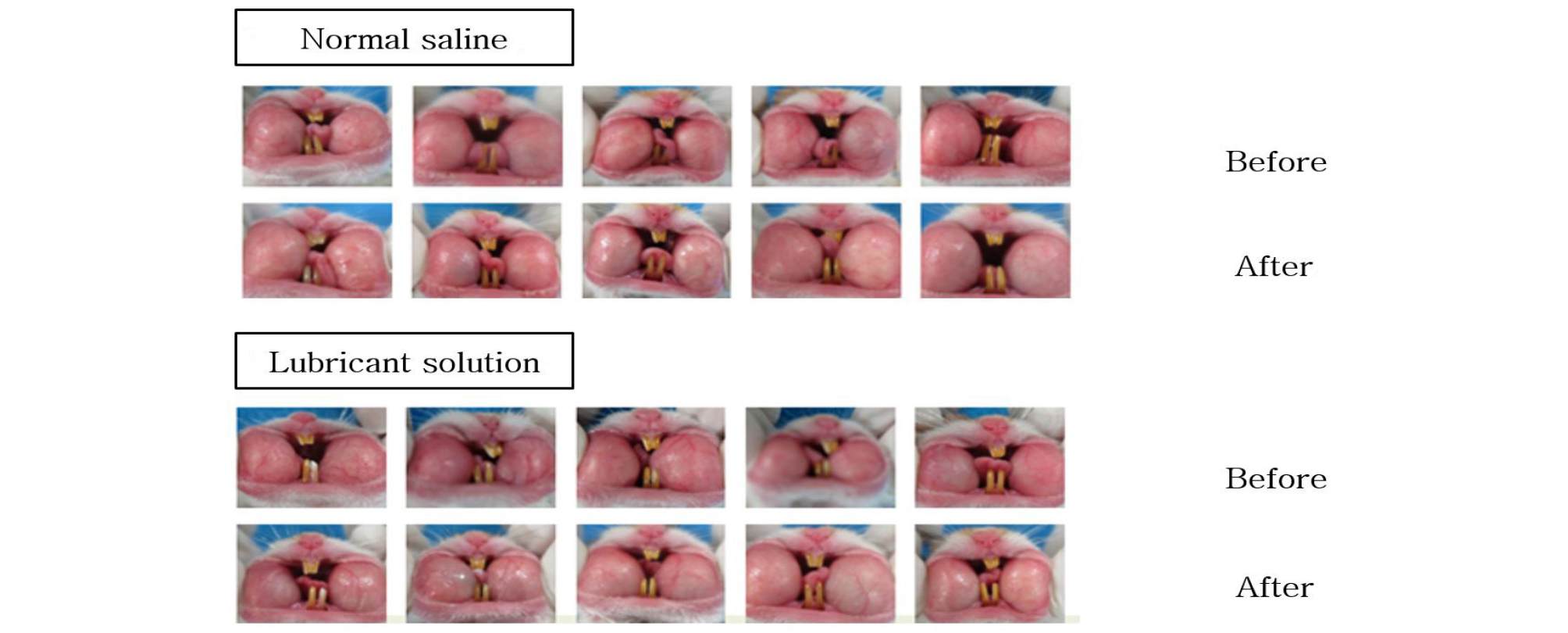
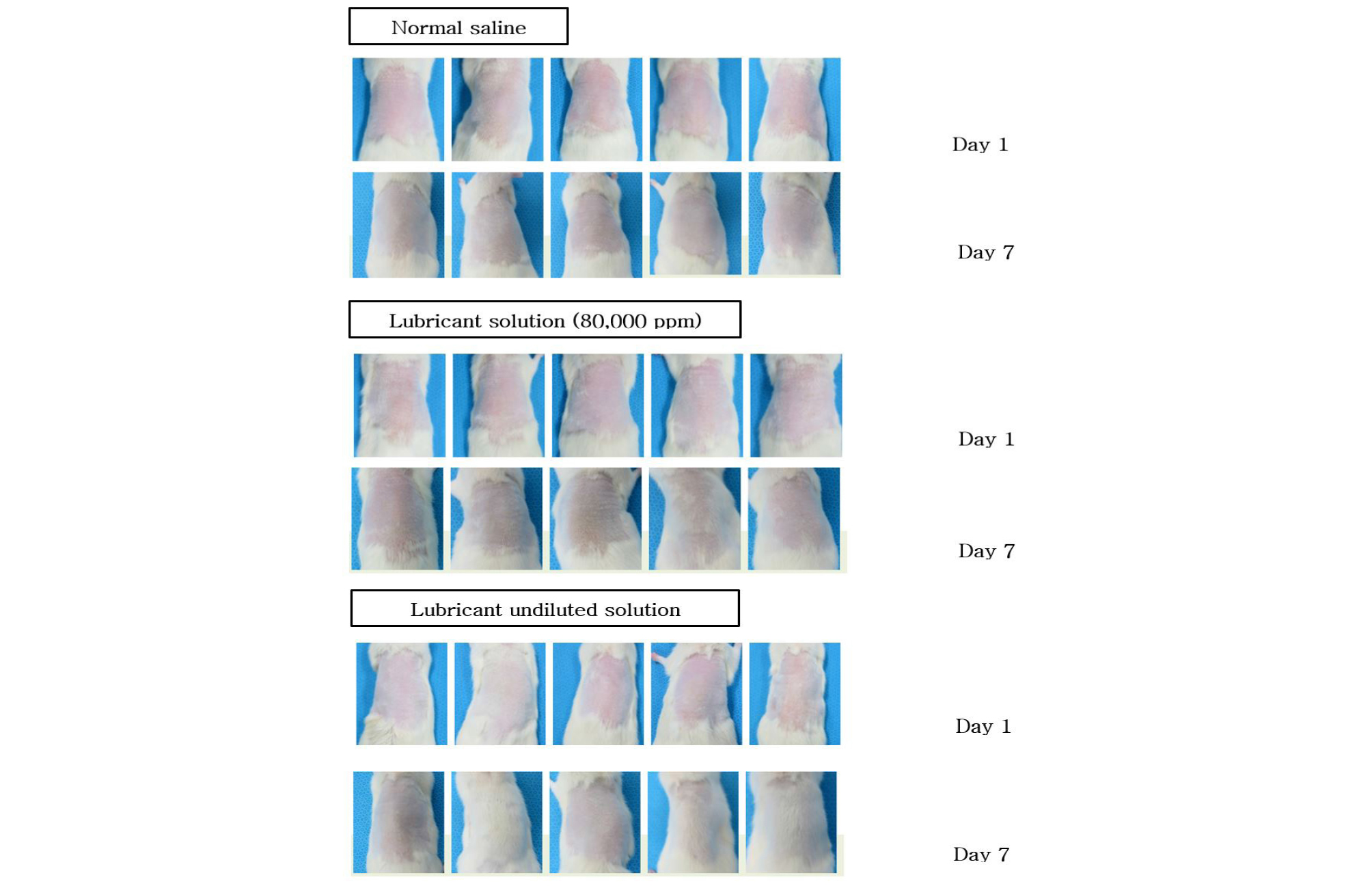
실험할 대상은 총 세 군으로, 각 군마다 SD rat 5마리씩 총 15마리로 진행하여 구강점막과 피부에 윤활제를 적용하였을 때의 자극성 여부를 평가하였다. 전자는 생리 식염수를 구강 점막에 자극하였을 때반응을 토대로, 8만 ppm의 윤활제를 적용한 군과 윤활제 원액을 적용한 군의 구강 점막을 관찰하였다. 후자는 피부에 적용하였을 때 반응을 토대로 평가하였으며, 실험 방법은 각 군마다 생리 식염수, 8만 ppm의 윤활제, 윤활제 원액을 피부 제모 후 tegaderm(3M, St. Paul, MN, USA) 및 gauze를 이용하여 1 ml씩 피부에 적용하고 하루 8시간씩 7일간 적용하면서 피부를 관찰하였다.
② 이물반응에 대한 평가를 피하 적용 시험
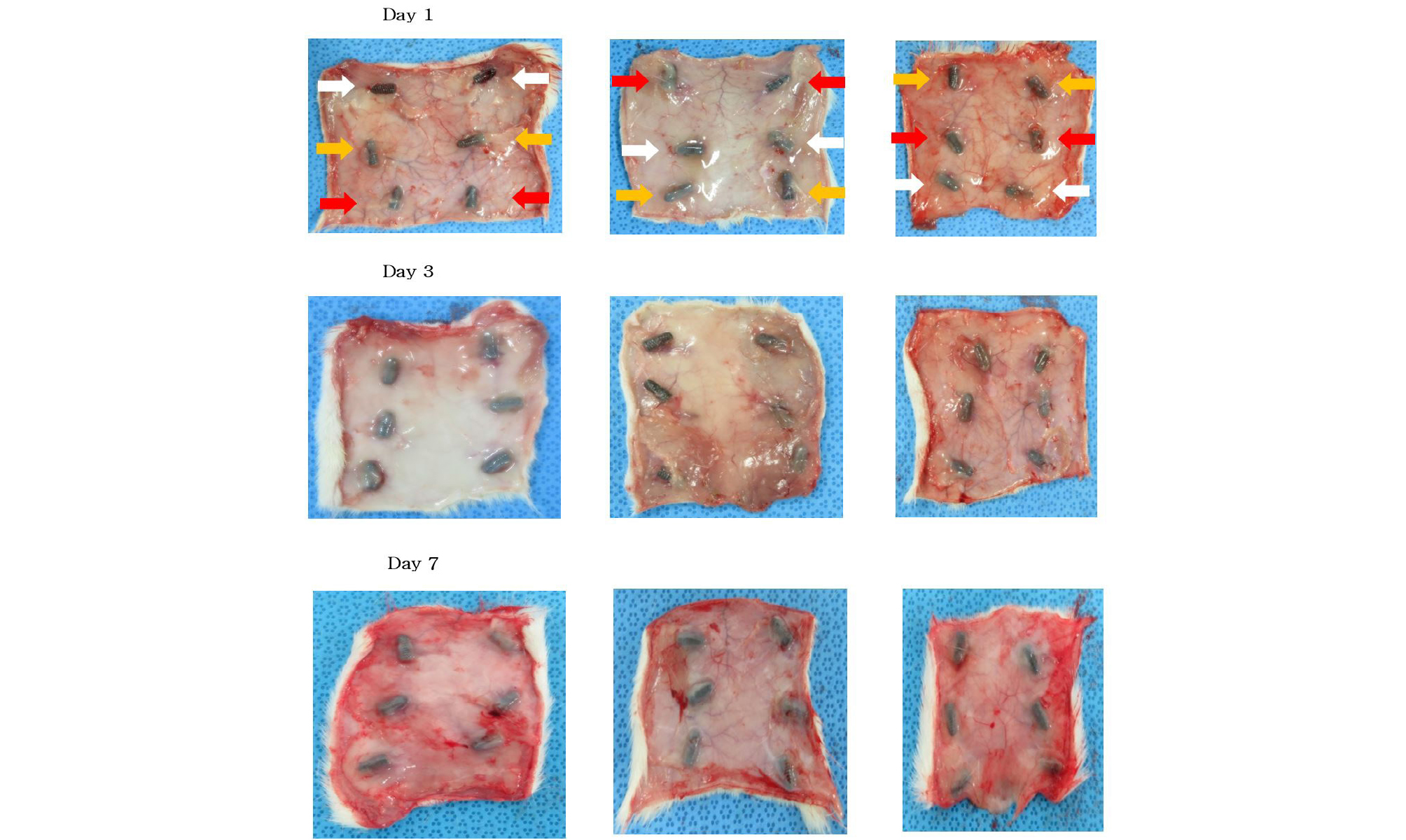
실험할 대상은 총 세 군으로, 아무런 처리를 하지 않은 식립체, 오일링과 공회전 후의 식립체, 윤활제 원액을 침지한 식립체를 이용하여 각 군마다 SD rat 6마리씩 총 18마리를 시행하였다. 방법은 SD -rat의 피부 제모 후 한 마리당 총 6개의 식립체를 피하에 이식하고 1, 3, 7일째 희생하여 반응 여부를 육안 으로 확인하였다.
3) 수술 후 관리
이식 후 피부는 4-0 blue nylon (Aliee Co., Ltd., Busan, Korea)로 봉합하였으며, 소독을 위해 포비돈 요오드 7.5%(Sungkwang Povidone Iodine Solution 7.5%, Sungkwang Ltd., Cheonan, Korea)용액을 술부에 도포하였다. 술 후 1일 1회 개체 상태를 확인 및 관찰하였다.
4) 동물 희생
1일, 3일, 7일 경과 후 아이소플루레인(Isotroy100, Troikaa Phama ceuticals Ltd., Gujarat, India) 3%를호흡마취기를 통하여 전신마취를 유도한 후, CO 2 가스에 과량의 마취를 통해 안락사 하였다.
Ⅲ. 결과
1. 핸드피스 내의 윤활제 잔류량
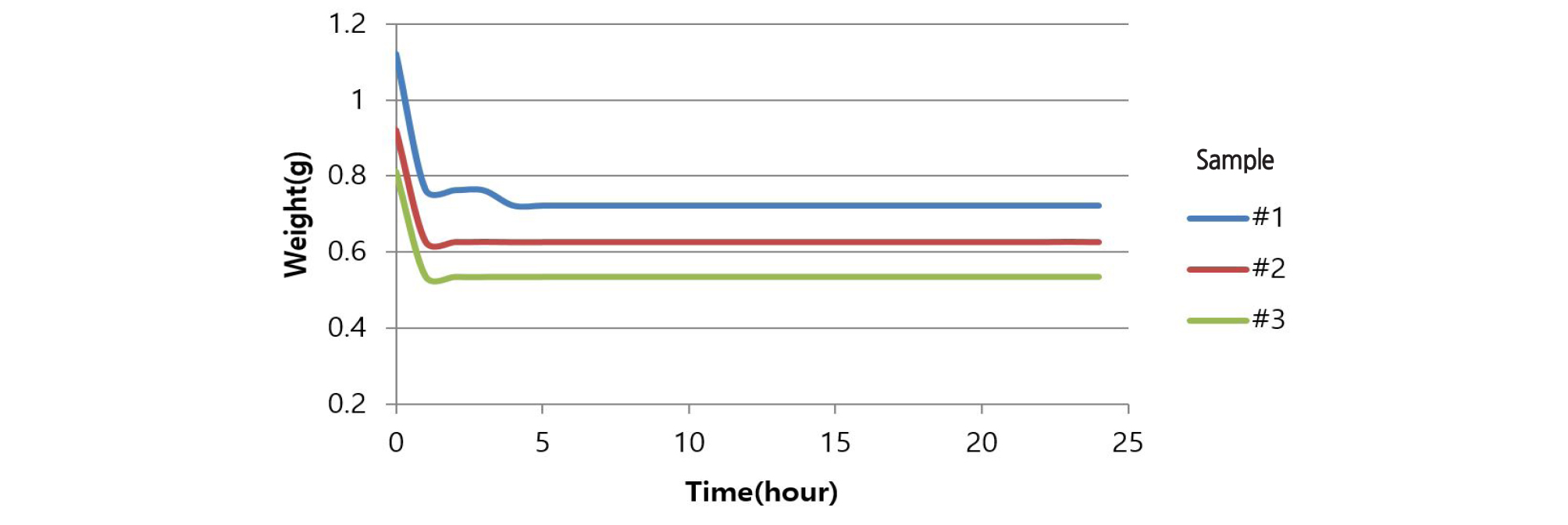
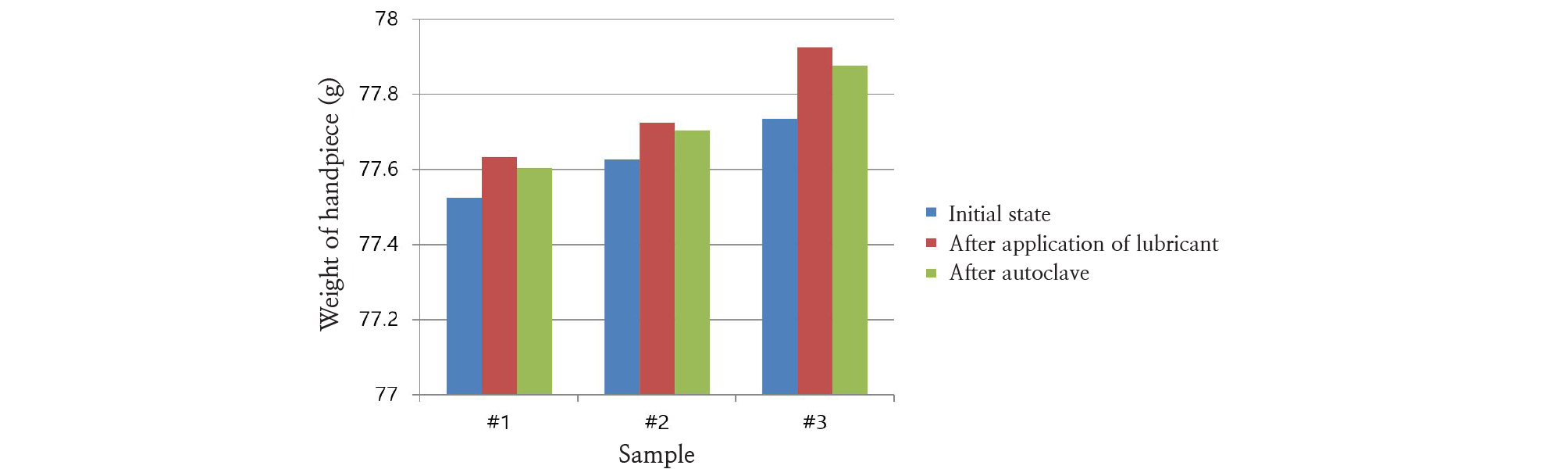
Fig. 1을 보면, 1시간 이내에 세 개의 유리 vial에서 비슷한 양상으로 무게가 감소하는 것을 볼 수 있는데 이는 propane, butane과 같이 윤활제에 포함되어 있는 가스의 휘발로 인해 발생한 것으로 짐작할 수있다. Fig. 2에서는 핸드피스 오일링을 시행하게 되면 핸드피스 내 과량의 윤활제가 잔류하는 것을 볼 수있으며, 고압증기멸균 전후를 비교하였을 때 핸드피스의 무게가 일부 감소하는 경향을 볼 수 있는데 그것은 단지 가스성분의 휘발로 인하여 발생한 것으로 볼 수 있어 실질적으로 멸균 단계에서는 오일이 거의 제거되지 않는다고 볼 수 있다.
2. 핸드피스 오일링 이후 식립 직전까지의 단계별 핸드피스에 잔류하는 윤활제 양에 대한 검증
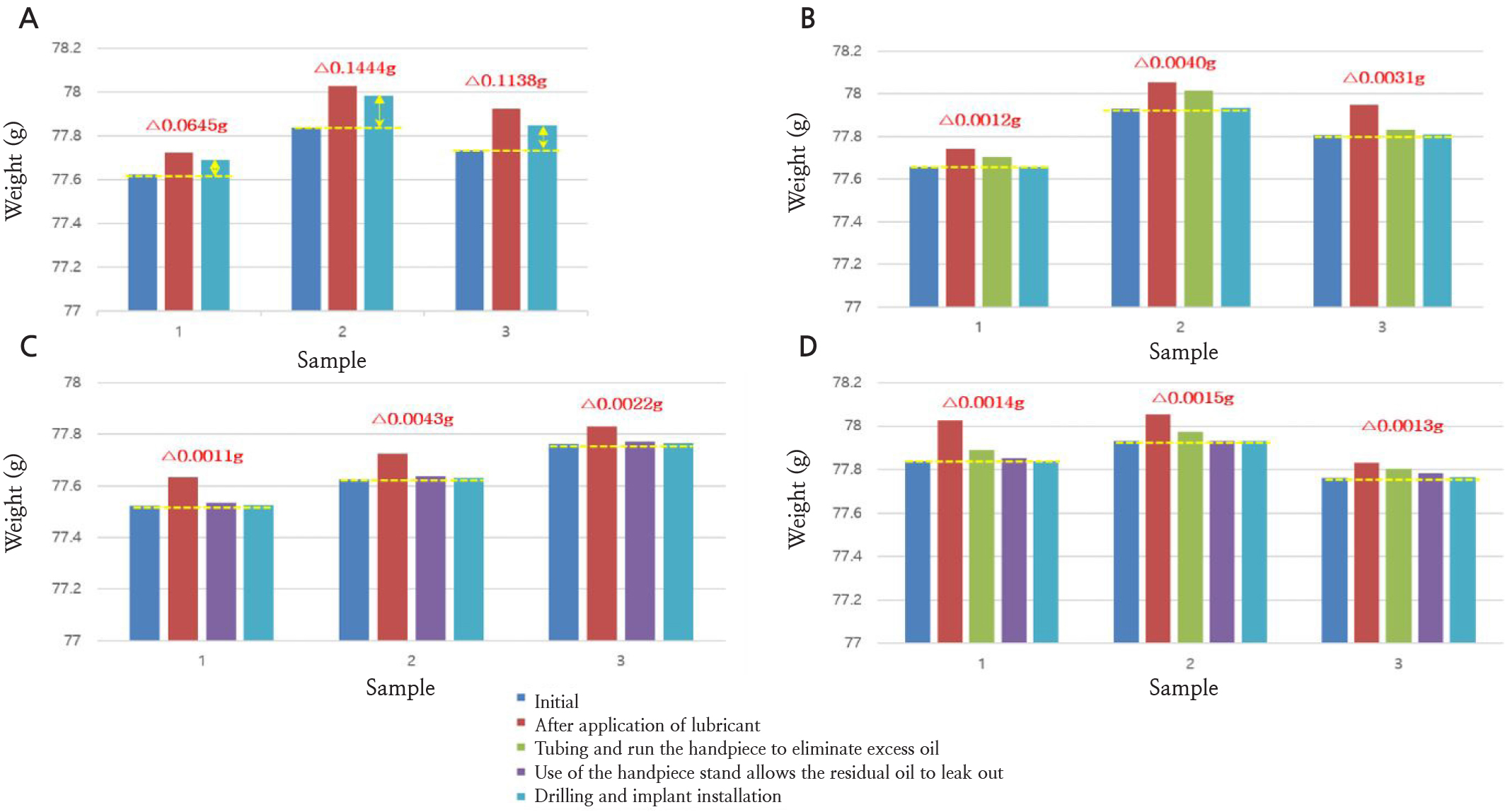
Fig. 3을 보면 A군에서는 윤활제 제거 단계가 없어 사용 후 핸드피스 내 과량의 윤활제가 잔류하고 있는 것을 볼 수 있었다. 그에 반해, 각 단계를 추가하여 D군으로 갈수록 사용 후 핸드피스 내 잔류하는 윤활제 양이 감소하는 것을 볼 수 있었다. 이러한 결과를 정리하여 윤활제를 적용한 직후와 드릴링 및 식립직후 윤활제 양의 차이를 통해서 환자에게 접촉가능한 윤활제의 양을 추정하였을 때, 최소 0.0003 g(3 ppm)에서 최대 0.079 g(80,000 ppm)까지도 방출될 가능성이 있다고 볼 수 있다(Table 1).
Table 1. The amount of lubricant remaining in the handpiece between the groups at each step. The amount of lubricant released to the patient can be estimated. The value was measured from a minimum of 3 mg to a maximum of 79 mg. (I, After application of lubricant; II, Tubing and run the handpeice; III, Used of the handpeice stand allows to leak out; IV,Driiling and implant installation; V, Amount of lubricant released to the patient)
| #A | #B | #C | #D | |||||||||
| 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | |
| I | 100 | 189 | 190 | 87 | 122 | 141 | 100 | 100 | 67 | 189 | 122 | 67 |
| II | 47 | 83 | 26 | 54 | 43 | 39 | ||||||
| III | 12 | 13 | 9 | 20 | 2 | 21 | ||||||
| IV | 64 | 144 | 114 | 1 | 4 | 3 | 1 | 4 | 2 | 1 | 2 | 1 |
| V | 35 | 45 | 76 | 46 | 79 | 23 | 11 | 8 | 7 | 18 | 3 | 19 |
3. 식립체에 잔류하는 윤활제 양에 대한 검증
GC 정량분석을 시행하였을 때, 대조군(Control)에서 검출되지 않았고, fixture를 윤활제에 침지하였을 때(Worst case group)에는 41,250 ppm까지도 검출되었다. 하지만 윤활제를 제거하는 단계를 거친 후에는 GC 정량분석검사에 검출되지 않았으며, 이는 윤활제가 완전 제거되었거나 검출 최소치인 25 ppm(0.025 mg) 이하의 잔류를 의미한다(Fig. 4).
4. L929 세포를 이용한 세포독성평가
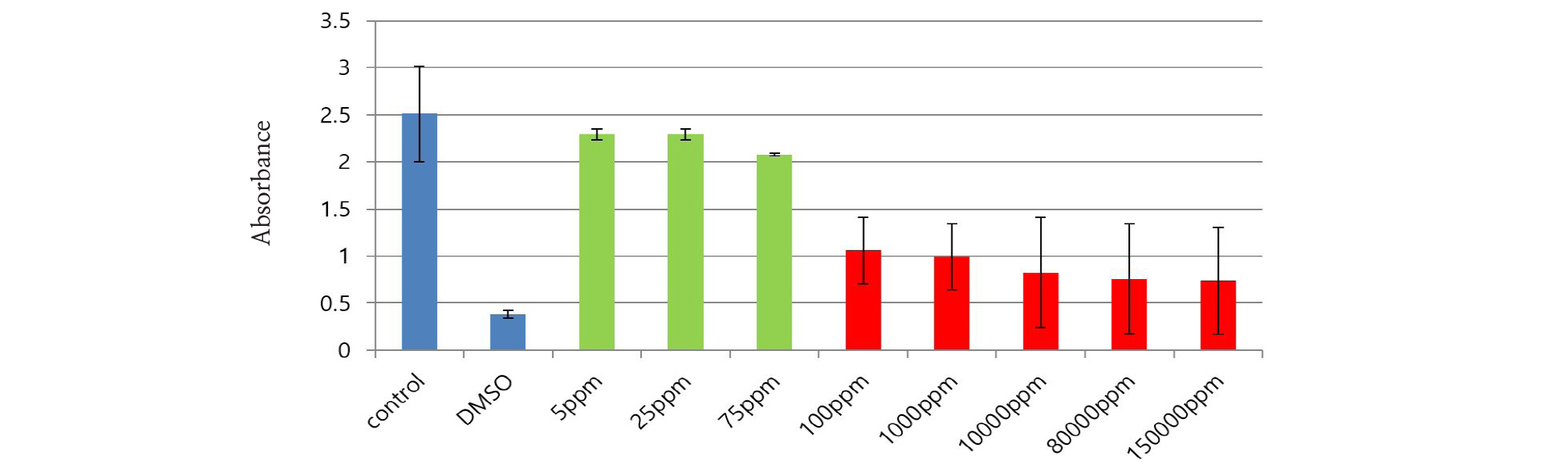
식립체 오일 잔류량의 최대치로 추정할 수 있는 25 ppm에서는 생존율이 대조군의 91% 수준으로 측정되었으며, 환자에게 접촉가능한 최대 윤활제인 80,000 ppm에서는 대조군에 비해 30% 수준으로 나타났다. 100 ppm 미만의 범위에서는 농도가 증가할수록 서서히 감소하는 경향은 보였지만 대조군과 비교하였을 때 평균 89%의 높은 생존율을 보였다. 그에 반해 100 ppm 이상에서는 150,000 ppm에 이르기 까지 급격히 감소하는 경향을 보였고 대조군과 비교하였을 때 평균 35%의 생존율을 보였다(Fig. 5).
5. 핸드피스 윤활제가 생체에 미치는 영향력에 대해 추가로 알아보고자 소동물(백서)을 이용하여 염증 발현 여부에 대한 검증
구강 점막 자극 시험, 피부 적용 시험, 피하 적용 시험 모두에서 대조군과 실험군을 비교하였을 때 특이할 만한 자극반응은 나타나지 않았다(Figs. 6-8).
Ⅳ. 고찰 및 결론
Zarb 등에 의하면 임플란트 성공의 기준은 기능적, 심미적으로 만족스럽고, 통증, 불편감, 감각이상, 감염이 없으며 임상 검사에서 임플란트의 동요도가 없는 것을 말하며15 성공의 기준을 만족하지 않은 경우 임플란트 실패로 판단한다. 그 중에서 임플란트의 조기 실패는 임플란트 식립 후 임플란트 기능 전까지 기간동안 관찰되는 임플란트의 상실을 말한다. Berglund에 의하면 하중이 가해지기 전 조기 실패율을 2.5%라고 보고한 바 있으며,16 최근 논문에서는 1.2%에서 3%로 보고하기도 하였다.17
임플란트의 조기 실패에 대한 원인이나 기전은 명확하지는 않다. Esposito에 따르면 조기 실패의 원인은 감염, 술 중 과도한 손상과 micromotion 그리고 불량한 치유능력에 있다고 한다.18 그 외에도 환자의 연령, 성별, 전신질환, 흡연,19 식립 위치,18 골질과 골양20 그리고 임플란트의 길이와 직경21 또한 영향을 줄 수 있으며, 면역학적 및 유전적 요인도 관련이 있다고 한다.14, 17, 22, 23, 24, 25, 26 게다가 임플란트 식립체의 표면 성질에 따라서도 골유착에 영향을 줄 수 있다고 알려져 있는데, 이전 논문에서 보면 식립체의 표면 거칠기가 증가하게 되면 BIC 또한 증가하는 것을 볼 수 있었고,27 6주만에 골유착이 이루어지는 것을 확인할 수 있었다.28, 29 하지만, 임플란트 식립체의 표면이 증가하게 된다면 동시에 식립체 표면이 오염될 가능성 또한 높아지게 되어 결과에 영향을 줄 수 있다. 특히 여러 문헌을 볼 때 세균에 의한 감염,30 내독 소의 부착,31, 32, 33 그 외 오염물질34, 35 은 골유착을 방해할 수 있다고 알려져 있다.
이번 논문은 외부로부터 유입되어 임플란트 식립체 표면을 오염시킬 수 있는 핸드피스의 윤활제가 실제로 골유착에도 영향을 주는지에 대한 연구가 많지 않아 그 영향을 알아보고자 실험실 내 세포실험을 통한 연구를 기획하고 진행하게 되었다. 이번 예비연구에서 사용된 윤활제의 종류가 한가지로 다양하지 않았다는 점에서 논란의 여지가 있을 수 있다. 또한, 세포독성시험에서는 윤활제가 배지 수면 위에 존재하여 CO 2 유입을 차단시켜 cell을 사멸시키게 된다는 가설로 시행하였으나, 윤활제의 밀도가 낮은 경우에는 완전히 덮지 못하고 부분적으로 덮으면서 CO 2 유입을 완전히 차단할 수 없게 되었다. 그리하여 100 ppm 미만에서는 높은 생존율을, 100 ppm 이상에서는 낮은 생존율을 보이게 되어 이 또한 문제 점으로 제시될 수 있다. 이렇듯 세포독성시험만으로 윤활제의 독성을 평가하는 데에 부족함이 있어 소동물(백서)를 이용한 실험을 추가로 진행하게 되었다.
백서에게 시행한 구강 점막 자극 시험, 피부 적용 시험, 피하 적용 시험 모두에서 대조군과 비교하였을 때 특이할 만한 자극반응은 나타나지 않은 것으로 보아 윤활제가 생체적합성은 양호하다고 볼 수 있었다. 하지만 이번 실험에서는 골내 식립을 직접 시행하지는 않았다는 점에서 골유착과의 관계를 입증 하기에는 부족함이 있다. 그리하여 추가적인 실험과 통계학적인 검증을 거쳐 이러한 관계에 대해서 입증할 필요가 있다고 생각된다.