I. 서론
치아상실, 외상, 종양 등으로 인해 구강 및 두개악안면 부위에 다양한 골 결손이 발생할 수 있다. 골 결손의 크기 및 상태에 따라 다양한 골이식술이 필요하며 자가골을 비롯하여 자가 치아 골이식재, 동종골, 이종골 및 합성골이 단독으로 혹은 복합적으로 사용되고 있다1, 2. 자가골은 골형성(osteogenesis), 골유도(osteoinduction), 골전도(osteoconduction) 기능을 모두 가지고 있으면서 면역 혹은 감염학적인 문제 발생 위험이 적으며, 혈행이 불량하거나 광범위한 결손부에 유용하게 적용할 수 있는 가장 이상적인 골이식재이다. 하지만 여전히 이식재 채취를 위한 추가적인 공여부가 필요하고, 그 특성 상 채취량에 제한이 있다는 단점이 존재한다3, 4. 따라서, 이러한 단점들을 극복하기 위해 동종골, 이종골, 합성골 등 다양한 재료들이 개발되었고 이미 널리 사용되고 있다. 이 중 특히 동종골은 자가골을 대체할 수 있는 좋은 이식재로 소개되고 있으며, 이와 관련된 많은 연구들이 진행되고 있다. 동종골은 이식재 채취를 위한 공여부가 필요치 않아 자가골 이식 시 공여부의 합병증이 없고, 별도의 채취 과정이 없기 때문에 술식이 단순하고 수술시간이 짧아지는 장점이 있다. 최근 다양한 동종골 제품들이 소개되고 있으며 이식 후 골재생이 이루어지는 치유 능력이 자가골에 비하여 크게 떨어지지 않는다고 보고되기도 하였다5. 하지만 광범위한 결손부에 동종골만을 적용할 수 있는지에 대하여 여전히 논란이 있으며 자가골에 비해 골형성 속도가 느린 것은 분명하다5, 6.
본 연구에서는 비글견의 두개골 전층 결손부에 자가골과 동종골을 이식한 후 치유 과정을 살펴보기 위한 예비 실험이 시행되었다. 본 연구에서 사용된 동종골 Double-Oss® (Dentree, Seoul, Korea)는 피질골과 해면골을 6:4의 비율로 혼합하여 각각의 장점을 최대화시킬 목적으로 제조된 제품이고 이 제품을 이식한 후 치유과정을 살펴본 논문이 거의 없기 때문에 본 예비 연구를 기획하게 되었다.
II. 연구 재료 및 방법
만 2살인 2마리의 비글견을 대상으로 예비 실험이 시행되었다. 비글견의 두개골(calvaria)에 인위적으로 골 결손부를 형성하여 골이식술을 시행하였다. 본 연구는 분당서울대학교병원 동물실험윤리위원회의 승인(BA1703-219/020-01)하에 시행되었다. 전신마취를 시행한 후 두개골 부위 털을 모두 면도하고 소독한 후 멸균 방포로 격리시키고, 2% Lidocaine HCl (1:10만 epinephrine 함유) 침윤마취를 시행하였다. 두개골 정중 봉합부 양측에 surgical bur를 사용하여 각각 10 × 10 mm 크기의 전층 골 결손부를 형성하였다. 2개의 결손부 중 1군데에는 동종골인 Double-Oss® (Dentree, Seoul, Korea)를 이식하였고, 다른 곳에는 대조군으로서 구강 내에서 채취한 자가골을 분쇄한 후 이식하였다. 자가골은 제 1, 3 소구치를 발치하면서 주변에서 골편을 채취하였다. 골 이식 후 2군데 모두 Ossguide® (Bioland, Cheonan, Korea)를 덮고 봉합하였다. 치유 과정을 평가하기 위하여 골 이식 4주 후와 8주 후에 희생시킨 후 비글견의 두개골 정중 봉합부에 절개를 가하여 2개의 이식부 주위의 정상 골조직을 포함하여 조직 시편을 채취하였다.
채취한 시편을 이동식 방사선 장비(DXR-1, EXARO, Seoul, Korea)를 이용하여 촬영한 후 시편들을 10% Formic Acid (Georgiachem Inc. Georgia, USA)로 3주간 탈회하고 조직절편제작기(Shadon Citadel 2000, Thermo Fisher Scientific Inc. Kalamazoo, USA)를 이용한 조직처리 과정을 거쳐 파라핀에 포매하였다. 그 후 조직절단기(Shadon Finesse 325, Thermo Fisher Scientific Inc. Kalamazoo, USA)로 모든 시편을 5 um 단위 두께로 연속적으로 분할하여 hematoxylin & eosin (H&E) 염색을 진행하였다. 신생골 형성 정도를 평가하기 위하여 컴퓨터와 CCD 카메라(SPOT Insight 2Mp scientific CCD digital camera system, Diagnostic Instruments Inc., Sterling Heights, USA), adaptor (U-CMA3, Olympus Co., Tokyo, Japan)가 연결된 광학현미경(BX51, Olympus Co., Tokyo, Japan)으로 영상을 획득하였다. 영상의 분석은 SPOT Software V4.0 (Diagnostic Instruments Inc., USA)를 통해 진행하였다.
III. 결과
1. 임상적 평가
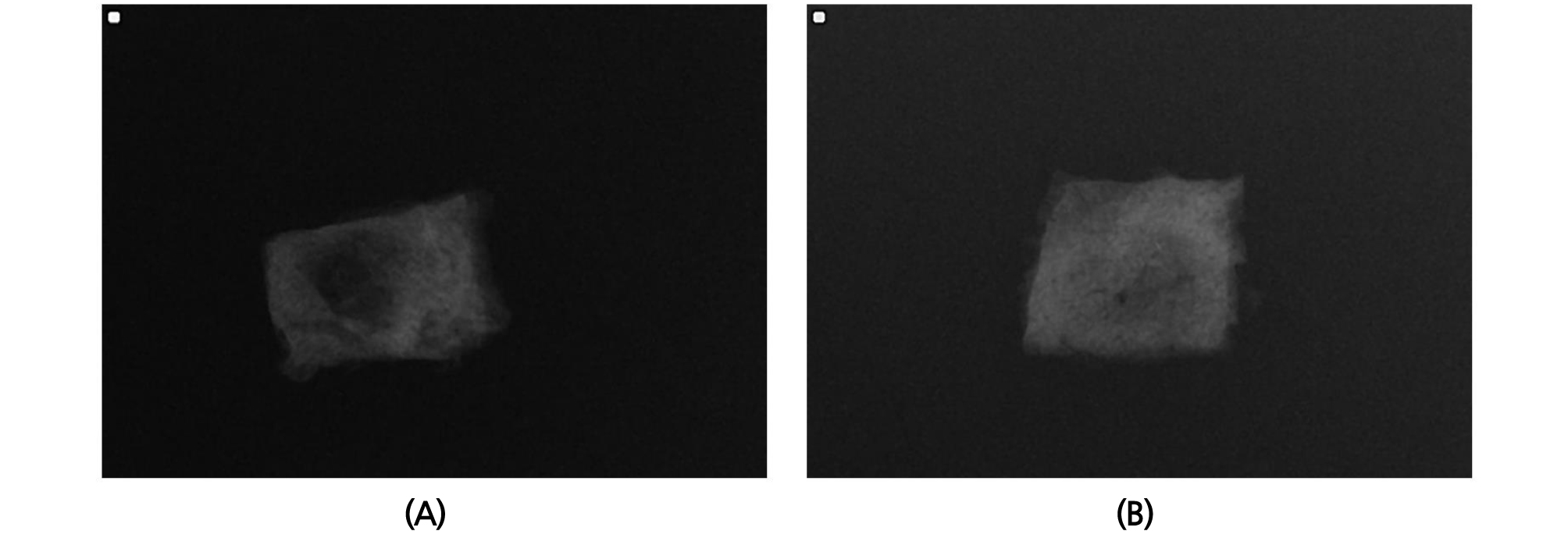
4주 후 자가골이 이식된 부위는 동종골이 이식된 부위와 마찬가지로 주위 골과 경계가 명확히 관찰되었지만 결손부의 크기는 더 작았다. 8주 후에는 자가골이 이식된 부위는 주변 골과 구별하기 힘들 정도로 결손부가 보이지 않았으나 동종골 이식부는 결손부가 아직 주변골과 뚜렷한 경계를 보이며 자가골에 비해 골형성이 덜 일어난 양상을 보였다.
2. 방사선학적 평가
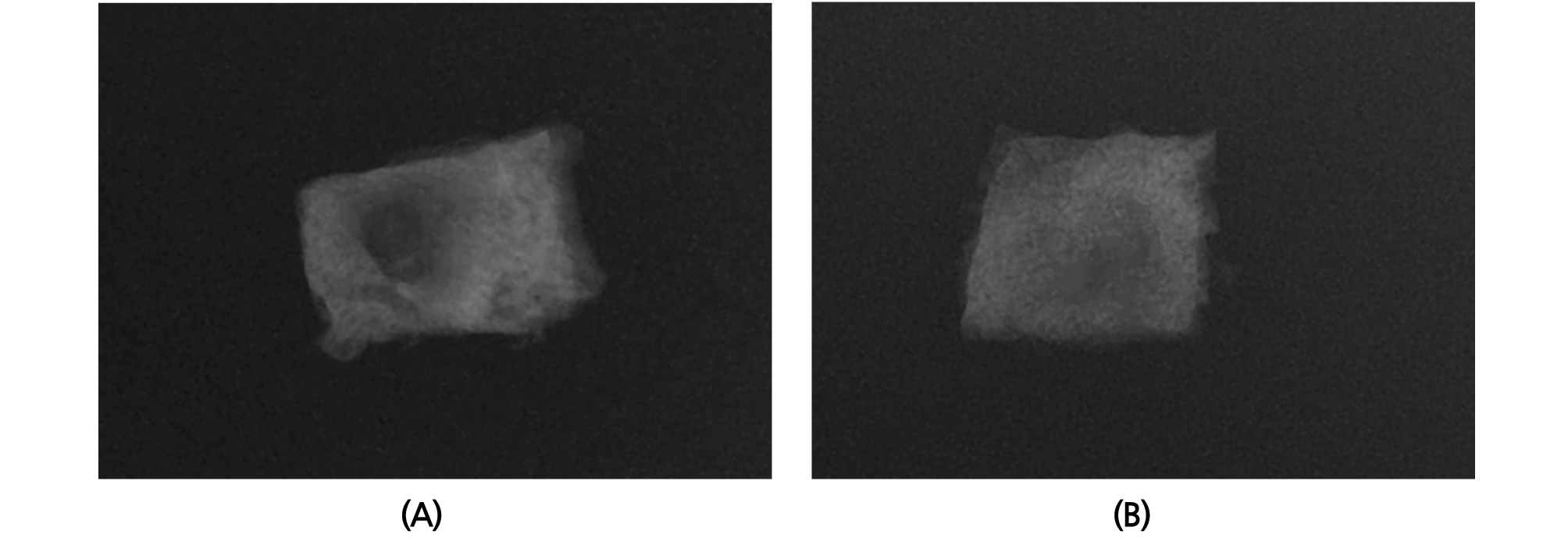
4주 후 채취한 시편의 방사선 사진상 동종골 이식부의 방사선투과상이 더 높았고 자가골 이식부는 방사선 불투과상이 높게 나타났다(Fig. 1). 8주 후에는 두 시편 모두에서 방사선 불투과상이 약간 증가하였으나, 여전히 자가골 이식부의 방사선 불투과상이 훨씬 높게 관찰되었다(Fig. 2).
3. 조직학적 평가
대조군인 자가골 군은 4주 경과 후 이식한 골이식재 주변에서 매우 활발한 신생골 형성이 관찰되었다. 반면 실험군인 동종골 군은 이식재가 있던 부분에서 신생골 형성이 일어나는 것이 아니라 결손부 주변의 잔존 골조직으로부터 소량의 신생골 형성이 관찰되었다. 8주 경과 후 자가골 군은 기존 골조직과의 경계를 알 수 없을 정도로 신생골과 잘 유합된 소견이 관찰되었다. 동종골 군도 4주 경과에 비해서 신생골 형성이 더 증가된 양상을 보였으나 자가골 군에 비해 신생골 형성량은 현저하게 적었다(Figs. 3, 4, 5, Table 1).
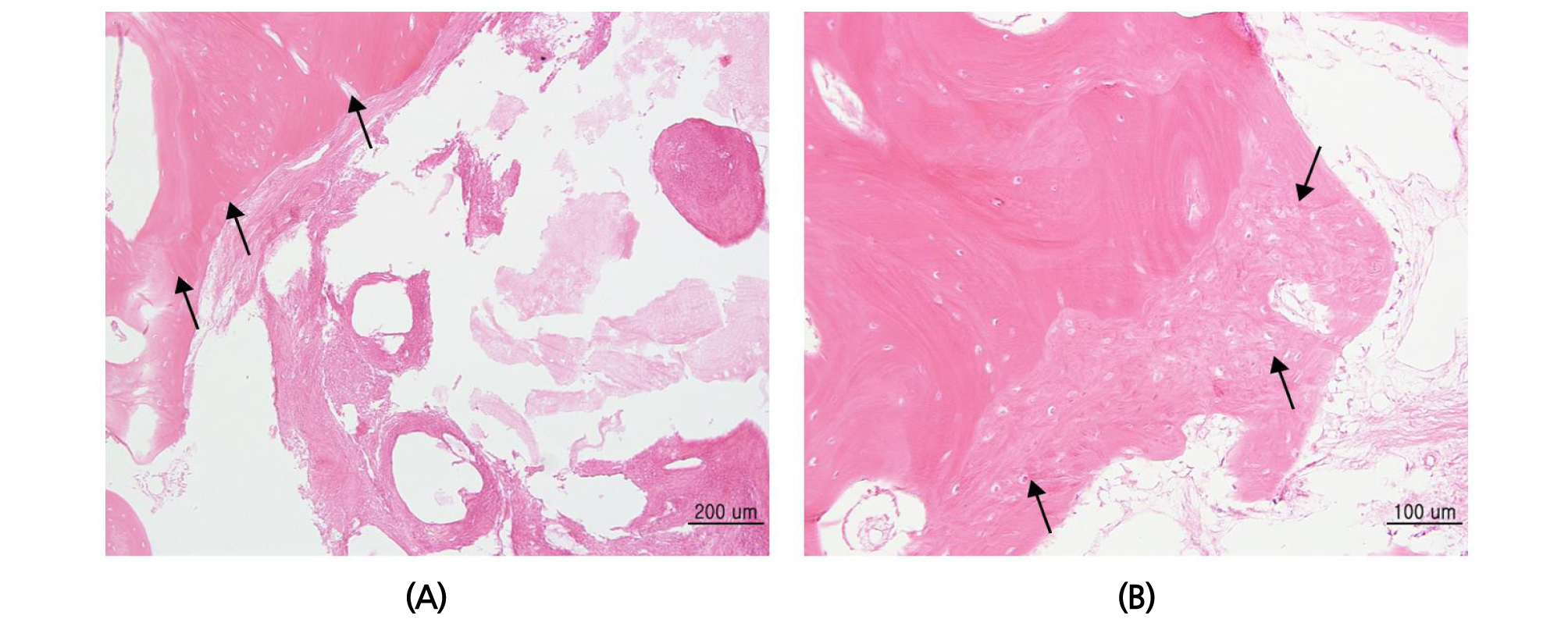
Fig. 3.
Histological findings after 4 weeks of bone grafting. (A) A small amount of bone formation was observed (arrow) between the Double-Oss and the existing bone. (B) The autogenous bone group showed a highly active new bone formation (arrow) around the implanted bone graft (Haemotoxylin/eosion, x 200.).
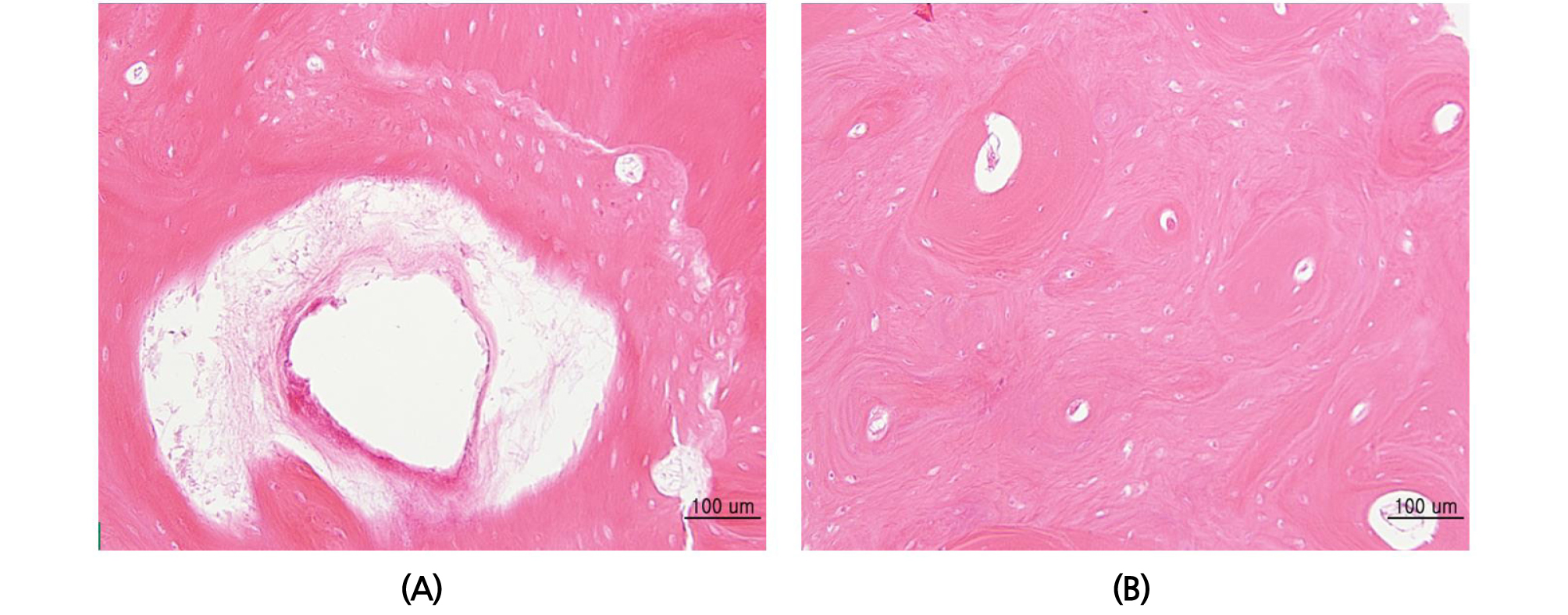
Fig. 4.
Histological findings after 8 weeks of bone grafting. (A) As the absorption of Double-Oss occurs, the new bones generated from the periphery of the existing bone is increased and the bone structure is developed. (B) No border can be found between the adjacent bone in the autogenous bone group (Haemotoxylin/eosion, x 200.).
IV. 고찰
신생골 형성에 관여하는 인자들 중에는 이식재의 입자 크기, 결손부의 잔존 골벽 수, 혈류 공급의 원활함 등이 있다. 이식재의 입자 크기는 골전도성 치유를 위해 중요한 요소이며 재 혈관화와 골 성장인자의 침투에 영향을 미친다. 또한 결손부의 잔존 벽들이 많이 남아 있을수록 자발적인 골치유가 잘 이루어지기 때문에 생체적합성이 있는 골이식재들을 이식하면 거의 유사한 치유를 보인다. 그러나 1-wall defect와 같이 잔존 벽 수가 적은 경우에는 골벽으로부터의 치유와 신생 혈관의 침투가 잘 이루어지지 않아 치유가 불량하거나 매우 지연되는 경향을 보인다. 따라서 잔존 골벽들의 수가 적을수록 자가골을 사용하는 것이 유리하며, 자가골 사용이 불가능한 경우엔 골유도 및 골전도성 치유가 우수한 동종골을 사용하거나 다른 골형성 촉진인자들과 함께 적용하게 된다. 건전 발치와와 같이 혈류 공급이 충분하고 결손부의 경우 크기가 작다면 별도의 골이식 없이도 골 형성이 일어날 수 있다7. 하지만, 혈류 공급이 원활하지 않은 경우에는 자가골을 반드시 사용하거나 적절한 골이식재와 함께 콜라겐이나 골형성단백질 등과 같은 골형성 촉진인자들을 병용하여야 한다6, 8, 9.
최근 자가골과 동종골을 비교한 연구에서 동종골이 자가골과 유사한 수준으로 골형성을 일으키고 합병증이 더 적기 때문에 임상적으로 유용하게 사용될 수 있다고 보고되었다10. 본 연구에서 사용된 Double-Oss는 피질골과 해면골의 비율이 6:4로 구성된 동종골로서, 골전도 기능이 좀 더 강화되었으며, 골성장인자 및 골형성단백질(BMP)을 함유하고 있어 골유도 효과도 우수한 재료로 알려져 있다. 동종골의 종류에는 fresh bone, fresh frozen bone (FFB), Freeze-dried bone allograft (FDBA), decalcified FDBA (DFDBA) 등이 있으나 fresh bone과 fresh frozen bone은 면역거부반응을 유발하기 때문에 임상에서 사용될 수 없으며 FDBA와 DFDBA가 자가골 대체재료로 많이 사용되고 있다. 동종골은 골유도와 골전도를 통해 새로운 골을 골을 만드는 것으로 알려져 있다3. 골유도성 치유는 탈회골의 세포외 기질에 존재하는 골형성단백질(bone morphogenic proteins: BMP)들이 이식 부위 주변의 미분화 간엽세포들을 자극하여 골전구세포들을 활성화시킴으로써 골형성을 유도하게 된다. 이러한 골유도능은 동종골의 종류에 따라 다양하다. 즉 BMP는 주로 피질골에 존재하며 탈회과정을 통해 방출되기 때문에 탈회피질골의 골유도 능력이 비교적 우수한 경향을 보이며 상대적으로 해면골이나 비탈회골은 골유도 능력이 다소 저하되는 경향을 보인다. 동종골을 사체로부터 채취하고 소독과정, 동결건조, 진공포장의 과정을 거치면서 BMPs (bone morphogenic proteins)의 파괴가 일어날 수 있고 BMP가 변성되면 이식재의 재혈류화를 지연시키면서 오히려 골치유를 방해할 수도 있다. 따라서 적절하게 처리된 동종골 제품을 선택하여 원칙에 입각한 골이식술을 시행하는 것이 우수한 골재생 효과를 얻을 수 있다5, 11-13.
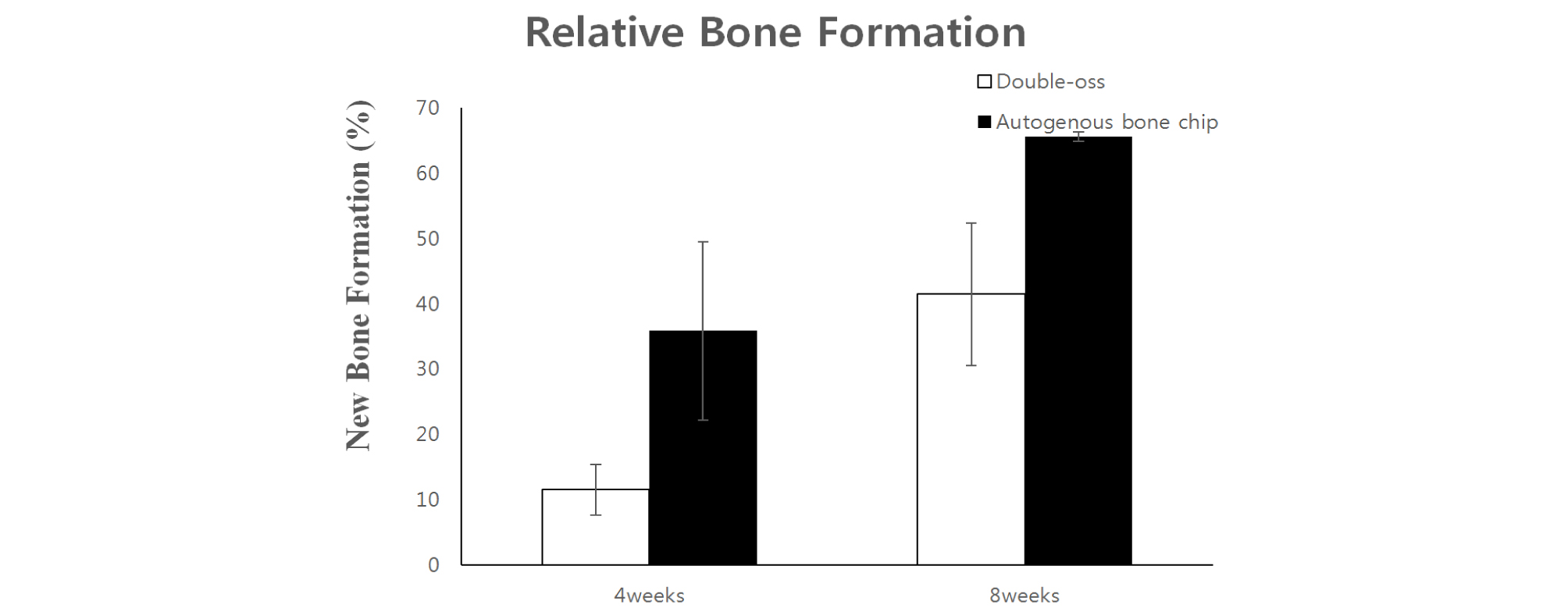
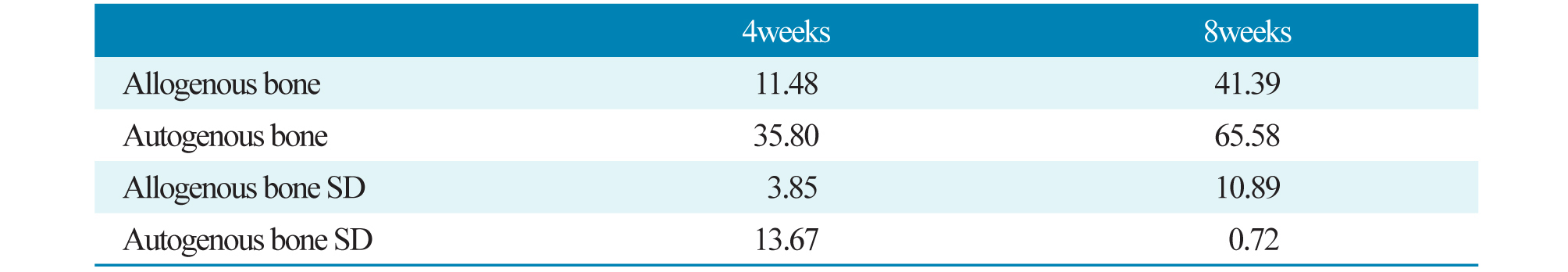
본 연구의 취지는 자가골 외의 다른 골 이식재로도 임상적으로 받아들일 만한 수준의 골형성을 일으킬 수 있는지 평가하기 위함이다. 따라서 본 실험에서는 비글견의 두개골 결손부에 자가골을 이식한 부위를 대조군으로 설정하였으며, 실험군은 시판되고 있는 동종골 이식재를 이용하였다. 이식 4주 후, 8주 후 모두 동종골에 비해 자가골 군에서 신생골 형성이 많이 발생하였다. 이식 4주 후 동종골 군의 신생골 형성 비율은 평균 11.5%였고 자가골 군은 35.8%를 나타내었다. 이식 8주 후 동종골 군의 경우 41.4%로 4주에 비해 확연히 증가하였으나 자가골 군의 신생골 형성비율 65.6%보다는 적게 나타났다. 조직학적 소견에서 동종골 이식의 경우 결손부 주변의 기존 골조직으로부터 골생성이 일어났다. 반면 자가골은 이식재 주변과 기존 골조직으로부터 활발하게 골형성이 이루어졌고 동종골에 비해 형성량이 현저하게 많았고 시간이 경과하면서 골성숙도가 증가하는 양상이 관찰되었다. 본 실험에서 비글견의 두개골에 형성한 지경 1 cm 크기의 결손부가 critical defect size인지 확실하지 않으며 동일 크기의 결손부에 골이식을 시행하지 않고 자연치유를 시킨 부위를 대조군으로 설정했어야 하는 아쉬움이 있다. 따라서 자가골과 동종골의 신생골 형성 효과에 대해 확실하게 결론을 낼 수 없는 문제점이 있다14. 그리고 표본의 수가 절대적으로 적은 점과 이로 인해 통계학적 검증이 불가능하였고 단순히 조직학적 치유 과정만으로 골치유 과정을 기술한 것들이 문제점으로 제시될 수 있다. 앞으로의 연구에서는 골이식재를 사용하지 않은 부위를 대조군으로 설정하고 표본의 수를 더 늘려서 실험을 진행하여 통계학적인 검증을 통해 동종골 이식재의 치유과정과 신생골 형성 능력을 입증할 필요가 있다고 생각된다.